Configuración electrónica
El siguiente simulador facilita el aprendizaje del orden en el cual se van rellenando los orbitales.Una vez entrado al link, clicear en el área de Química y ahí aparecerán diferentes simuladores. El que utilizaremos es el de configuración electrónica:
http://www.educaplus.org/game/ejercicios-de-configuracion-electronica-2
Tambien pueden analizar este constructor de átomos:
http://www.educaplus.org/swf/qui_atomos_iones_1_p.swf
En el estado fundamental de un átomo los electrones están distribuidos de tal forma que la energía de dicho átomo es mínima.
Para
deducir la configuración electrónica de un átomo, se utiliza el
principio de construcción (Aufbau). Este consiste en completar con
electrones los orbitales atómicos en orden creciente de energía. Es
decir, se comienza por el de menor energía, el nivel energético 1, donde
sólo hay un orbital s que puede ubicar 2 electrones.
El
número atómico del hidrógeno es 1, por lo tanto, para escribir su
configuración electrónica sólo se debe ubicar un electrón. Este ocupará
un orbital s del primer nivel energético, por lo tanto, su configuración
electrónica puede escribirse de la siguiente forma:
| nivel energético | | en orbital s hay un electrón |
Se
pueden representar los orbitales con una línea y los electrones con una
flecha, que apuntará hacia arriba o hacia abajo para mostrar electrones
girando en direcciones opuestas (con spines opuestos).
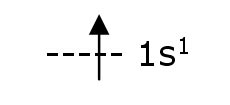
a) Escriban la configuración electrónica del He de la misma forma que se ha explicado.
Como
en el primer nivel no se pueden ubicar más electrones, se continúan
ubicando en el nivel 2. En este caso, existen dos subniveles de energía
posibles: 2s y 2p. Siempre el subnivel s es el de menor energía (en
cualquier nivel energético). Luego que se completa dicho subnivel con
dos electrones, se siguen ubicando en el subnivel 2p. Los subniveles p
son tres orbitales de igual energía donde se podrán ubicar seis
electrones en total (dos en cada uno de ellos).
Además, se debe tener en cuenta que:
• No
es posible que en un átomo dos electrones tengan los cuatro números
cuánticos iguales. Esto implica que en un mismo orbital atómico solo se
pueden ubicar dos electrones de spin opuesto (apareados). A esta regla
se la conoce como el principio de exclusión de Pauli.• Cuando hay más de un orbital en un subnivel, como en el caso de los orbitales p, primero se ubicará un electrón en cada orbital de igual energía y luego se aparearán. Al tener electrones desapareados, la repulsión es menor. Esto lo establece la regla de Hund.
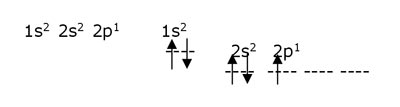
Por
ejemplo, si se quiere escribir la configuración electrónica del boro,
cuyo número atómico es 5, se deben distribuir esos 5 electrones en dos
niveles energéticos de la siguiente manera: